一致性评价加速,国内仿制药行业迎来新机遇
2016-9-7 11:11:52 来源:中国产业信息研究网 http://www.china1baogao.com/
近期,国家食品药品监督管理局(CFDA)大力推行仿制药一致性评价,特别是2016年3月5日,国务院办公厅印发《关于展开仿制药质量和疗效一致性评价的意见》之后,又连续发布征求意见和指导原则十余条,仿制药一致性评价进程有望不断加速。
一、仿制药一致性评价进程加速
国家药品安全“十二五”规划首次提出提升仿制药质量,随后,2013 年2 月国家药监局启动了仿制药质量一致性评价工作,并于2013 年7 月公布了75 个口服制剂名单及评价方法研究单位。随后根据《国务院关于改革药品医疗器审评审批制度的意见》的要求,2015 年发布了新的征求意见稿,扩大了一致性评价的范围,2016 年3 月发布了最新的仿制药质量和疗效一致性评价意见。对仿制药进行质量和疗效的一致性评价,就是要求已经批准上市的仿制药品,在质量和疗效上与原研药能够一致,在临床上与原研药可以相互替代,这样有利于节约社会资源,对促进医药产业升级和结构调整,增强国际竞争能力,都具有重要意义。
图表:2016年关于仿制药一致性评价的政策文件
|
|
相关政策文件 |
|
2015.12.01 |
《关于化学药生物等效性试验实行备案管理的公告》 |
|
2016.3.05 |
《关于开展仿制药质量和疗效一致性评价的意见》 |
|
2016.3.10 |
《关于对照药品一次性进口有关事项的公告》 |
|
2016.3.18 |
《普通口服固体制剂参加比制剂选择和确定指导原则》 |
|
2016.3.24 |
《药物溶出仪机械验证指导原则》 |
|
2016.3.28 |
《仿制药质量和疗效一致性评价工作程序(征求意见稿)》 |
|
2016.3.31 |
《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见(征求意见稿)》 |
|
2016.4.08 |
《人体生物等效性试验豁免指导原则(征求意见稿)》 |
|
2016.4.11 |
《仿制药质量和疗效一致性评价参比制剂备案与推荐程序(征求意见稿)》 |
数据来源:三胜咨询
中国产业信息研究网发布的《2016-2020年中国仿制药行业前景预测与市场供需深度调研报告》显示,过去十年中国仿制药市场发展迅速,总规模近5000亿元,仿制药在处方量中占比达95%。然而大量国产仿制药粗制劣造、安全无效,行业毛利率不到10%,远低于国际平均50%的水平。仿制药一致性评价工作终于落地,意义重大。预计到2017年,仿制药市场占比将提高到36%。由于各国对仿制药、专利药的政策导向不同,仿制药在新兴市场以58%的份额占据统治地位,而发达市场占比仅16%。
二、药品行业开始步入“质量和价值”时代,三类企业将受益
新药注册分类鼓励创新,注重临床价值及质量,长期利好创新型企业,短期对仿制导向型企业造成冲击。仿制药一致性评价主要目的是提高现有药品质量,CRO企业最为受益。政策鼓励创新、注重临床价值和产品质量,利好创新类企业、高质量仿制药企业和优秀的CRO企业。
图表:仿制药的一致性评价过程
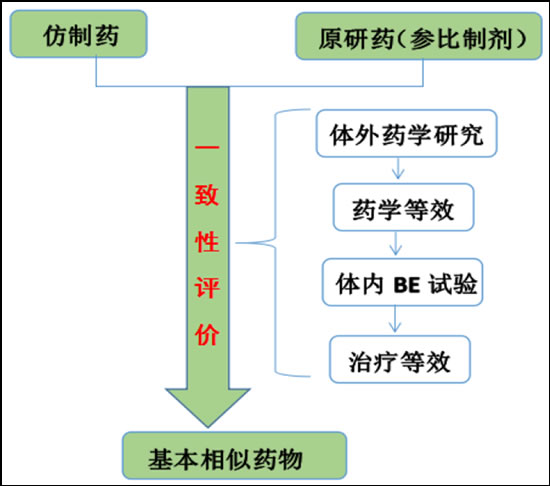
资料来源:三胜咨询
三类企业将受益于仿制药一致性评价:研发实力强、质量水平高的优质仿制药企业、CRO、药用辅料(特别是固体辅料)企业。此外,原料药质量也是影响一致性的因素,制剂企业对优质原料药的需求会增加,优质原料药企业也将一定程度上受益。
三胜咨询行业资深研究员张祥光认为,随着仿制药一致性评价工作的开展,对仿制药质量要求的提高将传导至上游的药用辅料行业。考虑到一致性评价以固体制剂为主制剂企业会在此过程中淘汰部分老辅料,选择新型辅料品种和优质辅料企业,因此固体制剂辅料的生产企业会获得更大机会,主要是山河药辅,红日药业子公司湖州展望也有较多固体辅料产品。此外,尔康制药拥有国家药用辅料工程中心,附可能以此平台承接其他制剂企业处方研究的订单,因此也值得关注。
- 一致性评价加速,国内仿制药行业迎来新机遇
- 供应链金融迎来政策契机,行业发展潜力巨大
- 无人机市场前景广阔,发展空间巨大
- 养生保健将达万亿规模,国内外企业群雄割据
- 我国文化产业面临重大调整,产业链布局逐渐完善
- 汽车改装政策逐步放宽,千亿级市场即将形成
- 美容连锁品牌快速扩张,美容发展潜力巨大
- 千年小阿胶:一张驴皮上铸的千亿大产业
- 网约车新政策出台,出租车改革步伐加快
免责声明:
1、本网转载文章目的在于传递更多信息,我们不对其准确性、完整性、及时性、有效性和适用性等作任何的陈述和保证。本文仅代表作者本人观点,并不代表本网赞同其观点和对其真实性负责。
2、中国产业信息研究网一贯高度重视知识产权保护并遵守中国各项知识产权法律。如涉及作品内容、版权和其它问题,请马上与本网联系更正或删除,可在线反馈、可电邮(link@china1baogao.com)、可电话(0755-28749841)。











